Científicos corrigen una enfermedad hereditaria en embriones humanos
 Científicos corrigen una enfermedad hereditaria en embriones humanos
Científicos corrigen una enfermedad hereditaria en embriones humanos
T13 En Vivo
Por primera vez en la historia, un equipo de científicos logró liberar a embriones humanos de ADN defectuoso que causa enfermedades cardíacas mortales.
El procedimiento, dicen los expertos, abre la puerta a la prevención de alrededor de 10.000 trastornos que se transmiten de generación en generación, pero a la vez reinstala el debate sobre los límites éticos que debería respetar la ciencia.
El histórico logro, anunciado este miércoles, fue realizado por un equipo de investigadores de Estados Unidos y Corea del Sur gracias a una nueva tecnología llamada CRISPR.
Esta técnica de "reparación" genética, considerada el mayor avance científico del año 2015, permitió lo que ahora llaman la "edad de oro" de la edición de ADN.
Menos de dos años después de la aparición de CRISPR, se logró la primera eliminación exitosa de una enfermedad genética en embriones humanos.
Las futuras aplicaciones de esta técnica en medicina son consideradas vastas e incluyen la posibilidad de eliminar las fallas genéticas que causan enfermedades como la fibrosis quística o el cáncer de mama.
La técnica
Científicos estadounidenses de la Universidad de Salud y Ciencias de Oregón y el Instituto Salk, junto con el Centro de Ciencias Básicas de Corea del Sur, centraron sus esfuerzos en corregir la falla genética que produce la cardiomiopatía hipertrófica.
El trastorno, considerado común, afecta a una de cada 500 personas y puede producir que el corazón deje de latir provocando una muerte súbita.
Es causado por un error en un solo gen (una instrucción en el ADN) y cualquier persona que lo lleve tiene un 50% de posibilidades de transmitirlo a sus hijos.
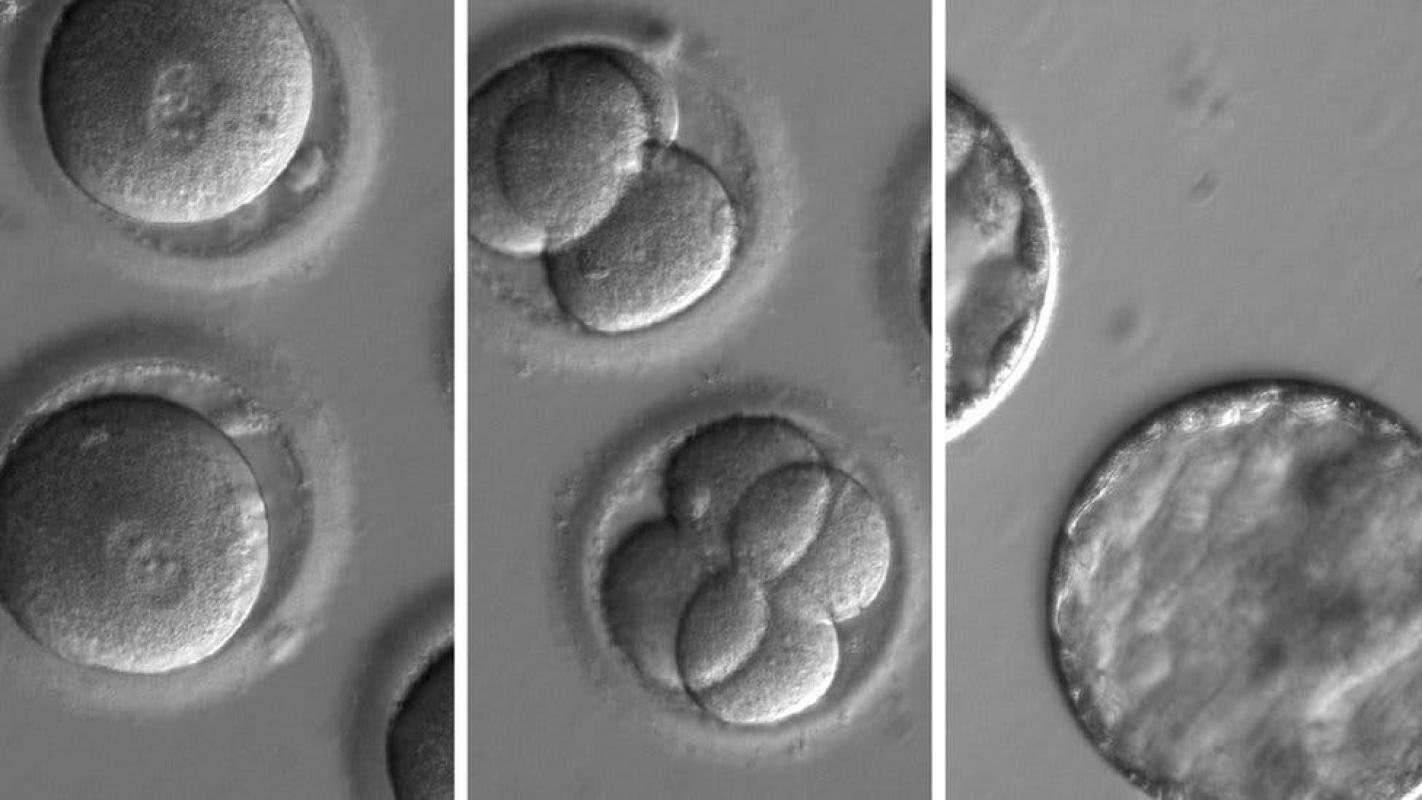
Según detalla la revista Nature, la reparación genética ocurrió durante la concepción.
El esperma de un hombre con cardiomiopatía hipertrófica se inyectó en óvulos donados sanos y se usó la tecnología CRISPR para corregir el defecto.
Si bien no funcionó en todos los casos, el 72% de los embriones resultaron libres de las mutaciones causantes de la enfermedad después del procedimiento.
El CRISPR porta una versión correcta del gen y se aplica inyectándolo en el óvulo junto a los espermatozoides.
Ninguno de los embriones estaba destinado a implantarse y fueron destruidos cinco días después de aplicada la técnica.
Beneficio eterno
Shoukhrat Mitalipov, uno de los líderes equipo de investigación, afirmó que "cada generación en adelante llevará la reparación porque se eliminó al causante de la enfermedad de la variante genética del linaje familiar".
"Mediante el uso de esta técnica, es posible reducir la carga de esta enfermedad hereditaria en la familia y, finalmente, en la población humana", afirmó Mitalipov.
Varios intentos de esta "reparación" se realizaron antes.
En 2015, científicos de China usaron CRISPR para tratar de corregir los defectos que generan trastornos sanguíneos.
En aquella oportunidad no lograron corregir cada célula, por lo que el embrión terminó como un "mosaico" de células sanas y enfermas.
Esos obstáculos técnicos han sido superados en la reciente investigación.
Sin embargo, aquello no significa que este procedimiento esté por convertirse en una práctica rutinaria.
Ahora el problema más importante, señalan los expertos, es la de la seguridad, y eso sólo puede ser superado por una investigación mucho más amplia.
Hay cerca de 10.000 desórdenes genéticos que son causados ??por una sola mutación y podrían, en teoría, ser reparados con esta tecnología.
El profesor Robin Lovell-Badge, del Instituto Francis Crick, señaló a la BBC que "un método para evitar que los niños reciban el gen afectado podría ser realmente muy importante para las familias".
Sin embargo, el experto añade que "va a pasar bastante tiempo antes de que tengamos la certeza de que sea un procedimiento seguro".
¿Ético?
Los hallazgos recientes, fundamentalmente a partir de la implementación de CRISPR, reavivaron el debate respecto a los límites de la ciencia.
El trabajo presentado por científicos estadounidenses y surcoreanos ya fue condenado por David King, miembro del grupo activista Alerta De Genética Humana (Human Genetics Alert), quien describió la investigación como "irresponsable" y parte de la "carrera por el primer bebé genéticamente modificado".
Darren Griffin, profesor de genética en la Universidad de Kent, opina que "quizás la pregunta más importante, y probablemente la que más se debatirá, es si debemos alterar físicamente los genes de un embrión de fecundación in vitro".
Sin embargo, el experto añade que también debería debatirse si es "moralmente aceptable no actuar cuando tenemos la tecnología para prevenir enfermedades que amenazan la vida".
Por su parte, Yalda Jamshidi, investigador de medicina genómica de la Universidad de Londres, ponderó que "el estudio es el primero en mostrar una corrección exitosa y eficaz de una mutación causante de enfermedades en embriones humanos en fase temprana con edición de genes".
"Aunque estamos empezando a comprender la complejidad de la enfermedad genética, la edición de genes probablemente será aceptable cuando sus beneficios potenciales, tanto para los individuos como para la sociedad en general, excedan sus riesgos", concluyó Jamshidi.
Pese a la polémica, el método no debería alimentar las preocupaciones sobre la posibilidad de crear "bebés de diseño" con rasgos ventajosos.
CRISPR fue diseñado para lograr la inserción de una nueva pieza de ADN manipulado en el código genético.
Sin embargo, para la completa sorpresa de los investigadores, esto no sucedió.
Lo que se logró con la técnica CRISPR fue dañar al gen alterado en el esperma del padre al colocar una versión saludable en el óvulo de la madre.
Esto significa que la tecnología, por ahora, sólo funciona cuando hay una versión saludable de uno de los padres.
Por ello el profesor Lovell-Badge, del Instituto Francis Crick, concluye que "la posibilidad de producir bebés de diseño, que es injustificable en cualquier caso, está ahora aún más lejos".