Cómo funciona el nuevo y polémico "viagra femenino"
 Cómo funciona el nuevo y polémico "viagra femenino"
Cómo funciona el nuevo y polémico "viagra femenino"
T13 En Vivo
La Food and Drug Administration (FDA), la máxima autoridad sanitaria de Estados Unidos, aprobó recientemente un nuevo medicamento para tratar el trastorno del deseo sexual hipoactivo en mujeres premenopáusicas.
El trastorno del deseo sexual hipoactivo (TDSH), o apatía sexual, está caracterizado por la ausencia reiterada y persistente del interés en realizar algún tipo de actividad sexual sin que esté vinculado a una causa específica.
Vyleesi, conocido químicamente como bremelanotida, es el segundo intento de la industria farmacéutica de ofrecer lo que se ha denominado como una "viagra femenina".
Se trata de un tema polémico, pues algunos expertos ponen en duda la propia naturaleza del desorden sexual y se critica la supuesta falta de rigor en la pronta aprobación de los fármacos para tratarla.
Inyección vs píldora
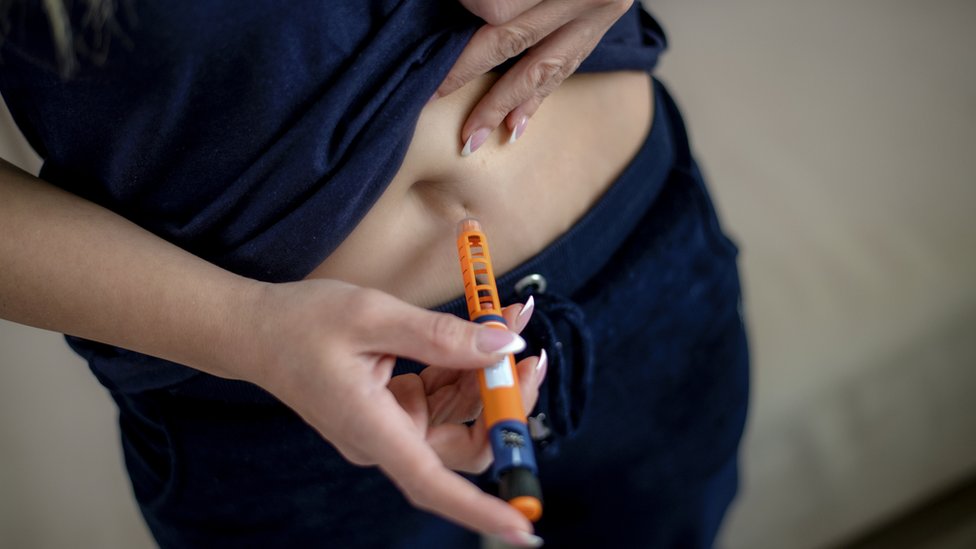
Desarrollado por Palatin Technologies y licenciado a Amag Pharmaceuticals, el nuevo fármaco se administra por medio de una inyección subcutánea que activa las vías cerebrales involucradas en el deseo sexual y estará disponible en algunas farmacias seleccionadas a partir de septiembre.
A diferencia de otros medicamentos relacionados, la bremelanotida no actúa sobre el sistema vascular, sino que directamente aumenta la libido actuando sobre el sistema nervioso.
Vyleesi competirá con Addyi, de Sprout Pharmaceutical, una píldora de uso diario que fue aprobada en 2015 con la contraindicación sobre el consumo de alcohol mientras se toma la pastilla.
Addyi fue aprobada después de un intenso cabildeo por parte de grupos de presión a pesar de la crítica de científicos de la FDA, que la consideraron mínimamente efectiva y posiblemente insegura.
Por su parte, Vyleesi no restringe el consumo de alcohol y se percibe con mayores ventajas sobre su competidor, incluyendo efectos secundarios tolerables, acción rápida y sin la necesidad de tomarlo todos los días, según los analistas.
Los efectos secundarios registrados durante los ensayos clínicos incluyeron náuseas entre moderadas y severas que duraron no más de dos horas y ocurrieron a lo largo de las primeras tres dosis, según la farmacéutica Amag. Un 40% de las pacientes en estos ensayos experimentaron náuseas.
El medicamento se aplica con una inyección en el abdomen o en el muslo mediante un autoinyector -un aparato en forma de lápiz con una jeringa y aguja hipodérmica con una dosis medida- 45 minutos antes de la actividad sexual.
La FDA recomienda a las pacientes no inyectarse más de una dosis en 24 horas y no más de 8 dosis por mes.
Los analistas calculan que un fármaco que pueda tratar de manera segura y efectiva la pérdida de deseo sexual en las mujeres podría reportar ventas anuales de unos US$1.000 millones.
"Sufrimiento silencioso"
Ciertos sectores de la comunidad médica consideran el TDSH un asunto serio y algunas estimaciones señalan que 1 de cada 10 mujeres lo sufren. En Estados Unidos, por ejemplo, el trastorno afecta a unas 6 millones de mujeres, pero pocas buscan o reciben tratamiento, según la agencia Reuters.
"Estas mujeres están sufriendo en silencio así que el mercado realmente no existe en la actualidad", declaró William Heiden, Director Ejecutivo de Amag, citado por Reuters.
La FDA manifestó cierto optimismo ante el lanzamiento del nuevo fármaco señalando que provee a las mujeres otra opción de tratamiento contra el TDSH.
"Hay mujeres que, por alguna razón desconocida, tienen un deseo sexual reducido que les causa una marcada angustia y que pueden beneficiarse de un tratamiento farmacológico seguro y efectivo", dijo Hylton Joffe, director del Centro de Evaluación de Medicamentos de la FDA, en un comunicado.
"Como parte del compromiso de la FDA de proteger y avanzar en la salud de las mujeres, continuaremos apoyando el desarrollo de tratamientos seguros y efectivos contra la disfunción sexual femenina".
Polémica
Sin embargo, la agencia reconoce que no sabe exactamente cómo Vyleesi actúa sobre el cerebro para estimular el deseo sexual.
También hay opiniones encontradas sobre si los fármacos son la estrategia correcta para el problema. El deseo sexual bajo puede ser el resultado de numerosos factores externos, psicológicos y fisiológicos, según diferentes especialistas.
También se debate qué tan recurrente es este trastorno.
Los críticos señalan que muchos de los médicos consultores en el desarrollo de fármacos contra TDSH son los mismos que definieron el desorden sexual en primer lugar.
Varias activistas en defensa de los derechos de la mujer consideraron que la FDA no congregó a un panel de asesores para escrutar el fármaco y que era necesaria mucha más información antes de aprobarlo.
Cynthia Pearson, directora ejecutiva de la Red Nacional de la Salud de la Mujer, en EE.UU, fue citada por el diario The Washington Post diciendo que su grupo estaba "decepcionado" tras la aprobación del fármaco y que las mujeres "simplemente no tienen suficiente información para tomar una decisión sabia sobre si el fármaco es seguro y efectivo".
La efectividad y seguridad de Vyleesi fueron estudiadas en dos ensayos controlados de 24 semanas con más de 1.200 mujeres premenopáusicas con TDSH.
La mayoría de las pacientes se aplicaron el fármaco dos o tres veces al mes pero no más de una vez a la semana. Aproximadamente 25% de ellas reportaron un incremento en su deseo sexual, comparado con más o menos 17% de mujeres a quienes les fue suministrado un placebo.
Los efectos secundarios registrados durante los ensayos incluyeron dolor de cabeza, sonrojo y náusea.
Ahora puedes recibir notificaciones de BBC Mundo. Descarga la nueva versión de nuestra app y actívalas para no perderte nuestro mejor contenido.
https://www.youtube.com/watch?v=sKD3t2kb2Us
https://www.youtube.com/watch?v=s1V3xOL23Zg&t=18s