COVID-19: Pfizer pedirá autorización de emergencia para su vacuna en noviembre
 COVID-19: Pfizer pedirá autorización de emergencia para su vacuna en noviembre
COVID-19: Pfizer pedirá autorización de emergencia para su vacuna en noviembre


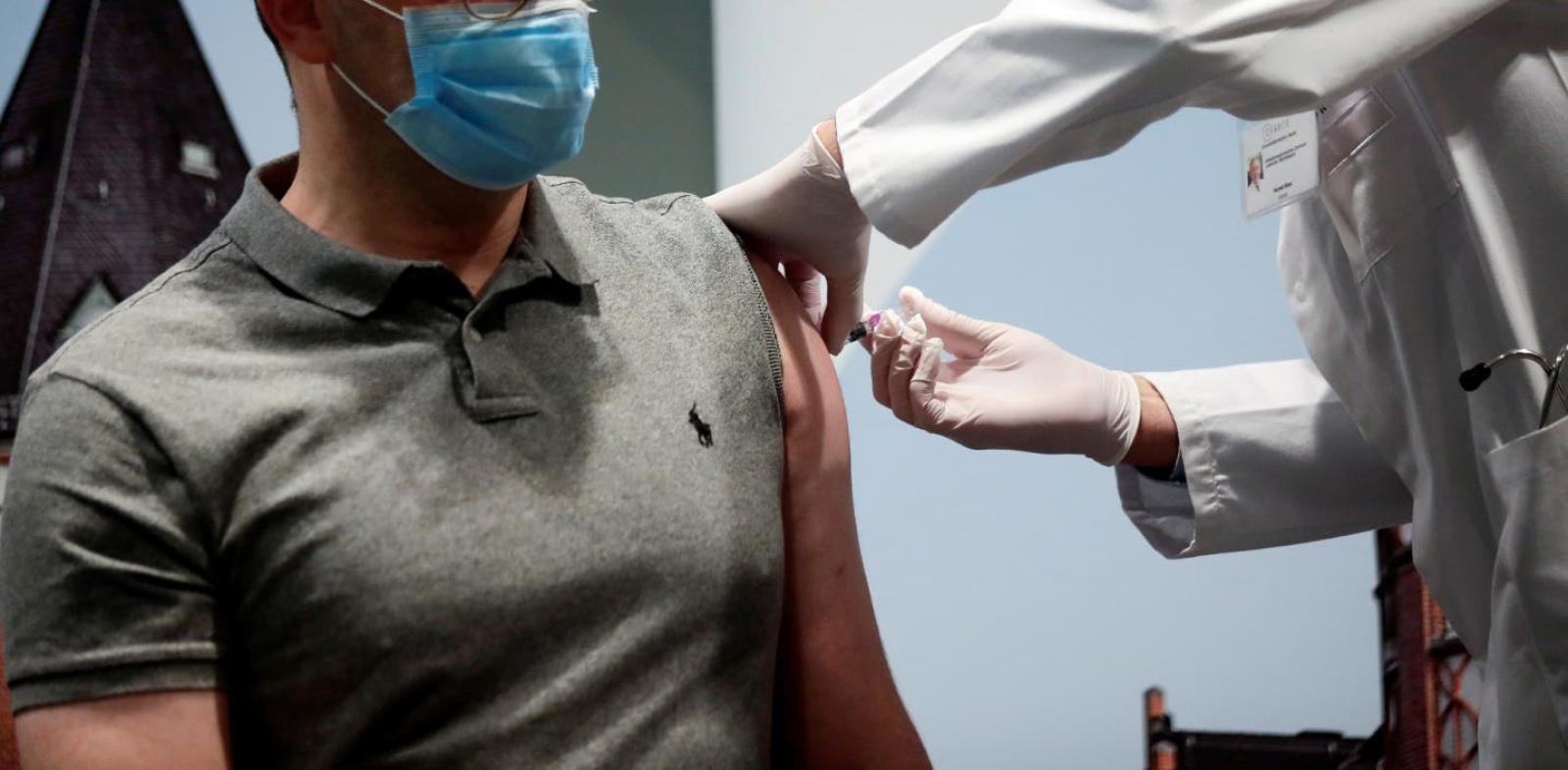
El gigante farmacéutico Pfizer anunció que planea solicitar una autorización de emergencia para su vacuna contra el COVID-19 a fines de noviembre; unas dos semanas después de las elecciónes en Estados Unidos.
En julio comenzaron los estudios de la Fase 3 aplicando la vacuna a 44 mil voluntarios de entre 18 a 85 años en Estados Unidos, Alemania, Brasil y Argentina.
"Permítanme ser claro, suponiendo que los datos sean positivos, Pfizer solicitará una autorización de uso de emergencia en Estados Unidos poco después de que culmine la etapa de seguridad, en la tercera semana de noviembre", dijo Albert Bourla en una carta abierta publicada en las redes sociales.
Estados Unidos podría tener dos vacunas listas para finales de año -si las pruebas clínicas en curso son concluyentes y si la Administración de Alimentos y Medicamentos (FDA) autoriza su distribución- ya que Moderna también estima tener lista la suya a finales de noviembre.
La FDA establece tres condiciones para la aprobación de una vacuna: que sea efectiva, que sea segura y que la compañía sea capaz de producirla a gran escala.
Pfizer espera cumplir con los tres requisitos en la tercera semana de noviembre, o sea dentro de un mes.
En Chile
En septiembre de este año la farmacéutica afirmó que la vacuna que desarrollan podrían llegar a Chile en enero de 2021 luego que el Gobierno firmara un acuerdo para acceder a 10 millones de dosis.
Marta Diez, gerenta general de Pfizer en Chile, aseguró que "asumiendo que los datos clínicos y los protocolos regulatorios son exitosos, el registro local ante el ISP podría estar a fin de año".










