Así funciona el bamlanivimab, el primer medicamento específico contra el COVID-19
 Así funciona el bamlanivimab, el primer medicamento específico contra el COVID-19
Así funciona el bamlanivimab, el primer medicamento específico contra el COVID-19
T13 En Vivo
Francisco López-Muñoz, Universidad Camilo José Cela and Jose Antonio Guerra Guirao, Universidad Complutense de Madrid
La agencia reguladora de medicamentos norteamericana, FDA (Food and Drug Administration), acaba de emitir una autorización de uso de emergencia (EUA, Emergency Use Authorization) para el tratamiento de la covid-19 de intensidad leve a moderada en pacientes adultos y pediátricos que no han sido hospitalizados. La terapia, todavía en investigación, está basada en anticuerpos monoclonales y tiene el nombre de bamlanivimab.
Este agente terapéutico, desarrollado por la compañía farmacéutica Eli Lilly, es un anticuerpo monoclonal similar a los que formaban parte del cóctel de medicamentos para la covid-19 que se administró a Donald Trump.
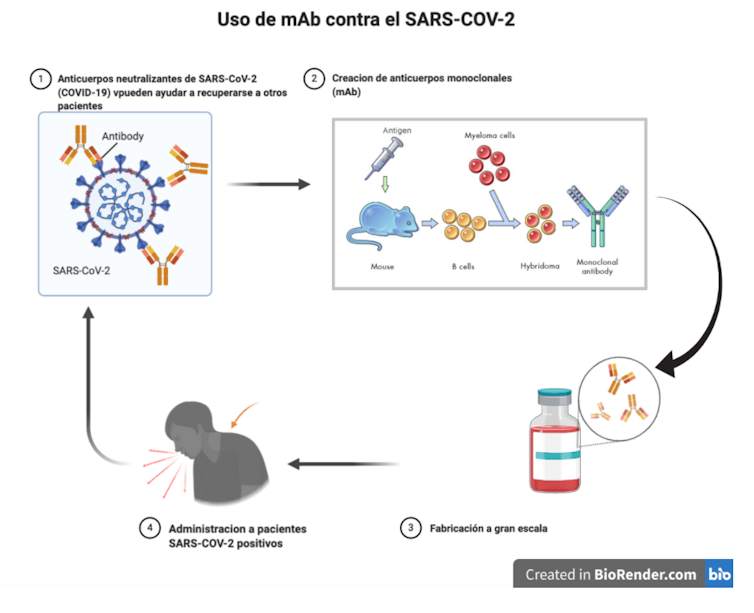
¿Qué son los anticuerpos monoclonales?
Por lo general, los anticuerpos son grandes proteínas integrantes del sistema inmunológico necesarias para identificar y neutralizar objetos extraños al organismo, como bacterias y virus.
En el caso concreto de los anticuerpos monoclonales (mAbs, del inglés monoclonal antibodies), se trata de glicoproteínas producidas por el clon de una célula híbrida (creada a partir de la fusión de una sola célula madre del sistema inmune y una célula plasmática tumoral) y diseñada para atacar a un antígeno concreto.
Su producción se basa en el establecimiento de linfocitos B inmortales modificados para producir una inmunoglobulina específica. Según el nivel de pureza de la inmunoglobulina, ésta puede ser completamente murina, quimérica, humanizada o completamente humana.
Los anticuerpos monoclonales se seleccionan cuidadosamente y se dirigen contra una molécula concreta que desempeña una función clave en un proceso patológico, y suelen utilizarse en el tratamiento de ciertas enfermedades como el cáncer o la artritis reumatoide.
¿Y los anticuerpos neutralizantes?
Los anticuerpos neutralizantes constituyen una de las posibles defensas que tiene el sistema inmunitario frente a las infecciones.
Estos anticuerpos permiten contrarrestar y eliminar el efecto de microorganismos invasores, y su actividad se desencadena, por ejemplo, gracias a proteínas situadas en la superficie de los virus, a las que se unen para “bloquear” la infección.
En este sentido, la comunidad científica lleva tiempo estudiando si la respuesta defensiva mediante anticuerpos neutralizantes puede inducir inmunidad efectiva y duradera. Y, más concretamente, se está investigando si los anticuerpos generados por pacientes que han estado en contacto con el coronavirus SARS-CoV-2 podrían utilizarse como base para nuevos tratamientos de la covid-19.
Sin embargo, aunque los anticuerpos neutralizantes se generan cuando una persona sufre una infección y parecen que juegan una función importante en la respuesta inmunitaria, su papel concreto en los engranajes de la covid-19 no está del todo dilucidado.
Los estudios llevados a cabo hasta el momento con el virus SARS-CoV-2 señalan que los anticuerpos neutralizantes aparecen unas dos semanas tras comenzar la infección, y que su pico máximo de actividad se situaría entre las semanas 4 y 6. Pero existen aún muchas incógnitas: no se ha confirmado si todos los pacientes infectados generan anticuerpos neutralizantes; qué factores determinan su aparición y actividad (edad del paciente, gravedad de la infección). Tampoco si sus niveles de neutralización son siempre suficientes para conferir protección, ya que estos niveles son muy variables y no se detectan en el 10-30 % de los pacientes.
La entrada de SARS-CoV-2 en las células se inicia por la interacción del dominio de unión al receptor (RBD) de la glicoproteína viral Spike (S) con la enzima convertidora de angiotensina-2 (ACE2), que actúa como receptor del virus en la superficie de la célula diana. Los mAb neutralizantes más potentes se dirigen al RBD y algunos pueden actuar simplemente compitiendo con el receptor para unirse a la proteína S.
¿Qué es el bamlanivimab?
El bamlanivimab es un anticuerpo monoclonal IgG1-kappa humano recombinante neutralizante contra la proteína Spike del virus SARS-CoV-2, y no está modificado en la región Fc.
Este agente está autorizado para el tratamiento de pacientes con resultados positivos en las pruebas del SARS-CoV-2 que tengan 12 años de edad o más y pesen al menos 40 kilogramos y que tengan un alto riesgo de progresar a covid-19 grave u hospitalización. Esto incluye a aquellos pacientes que tienen 65 años de edad o más, o que presenten ciertas afecciones médicas crónicas. El bamlanivimab es un medicamento que debe ser aplicado por vía intravenosa, por lo que los pacientes deben acudir a un centro hospitalario para que les sea administrado.
Si bien se sigue evaluando la seguridad y la eficacia de esta terapia en fase de investigación, los ensayos clínicos han confirmado que el bamlanivimab, en comparación con placebo, reduce las hospitalizaciones o las entradas a los servicios de urgencia relacionadas con la covid-19 en pacientes con alto riesgo de progresión de la enfermedad, dentro de los 28 días posteriores al inicio del tratamiento. Por este motivo, su uso es recomendable en las primeras fases de la enfermedad, a ser posible en los primeros 10 días tras la aparición de los síntomas de la enfermedad.
Sin embargo, el bamlanivimab no está autorizado en el caso de pacientes hospitalizados por covid-19 o que requieran oxigenoterapia, ya que no se ha demostrado un beneficio significativo del tratamiento con este anticuerpo monoclonal en pacientes hospitalizados con covid-19. Y, de hecho, los mAb, como el bamlanivimab, pueden estar asociados con peores resultados clínicos cuando se administran a pacientes hospitalizados con covid-19 que requieren alto flujo de oxígeno o ventilación mecánica.
Con respecto al perfil de seguridad, los efectos adversos de los mAb, en general, se pueden agrupar en dos tipos diferentes: los derivados de la acción del anticuerpo, como infecciones oportunistas, infecciones comunes o desarrollo de fenómenos autoinmunes; y los derivados de la administración de proteínas: reacciones anafilácticas, síndrome de liberación de citoquinas y desarrollo de anticuerpos. En el caso concreto del bamlanivimab, las reacciones adversas más frecuentemente comunicadas a la FDA han sido náuseas, mareos, dolor de cabeza, prurito, hipersensibilidad inmediata no grave, diarrea y vómitos.

En conclusión
El bamlanivimab constituye una nueva herramienta terapéutica en la lucha contra la covid-19 que ha sido autorizada de forma condicional en EE. UU., bajo el epígrafe de Emergency Use Authorization, lo que implica, al igual que ocurre en Europa, que satisface una necesidad médica no cubierta, en la medida en que el beneficio para la salud pública de su inmediata disponibilidad es superior a la incertidumbre derivada de la limitación de los datos clínicos disponibles.
Sin embargo, la compañía farmacéutica responsable del desarrollo, Eli Lilly, debe comprometerse a proporcionar más datos clínicos que completen la información sobre eficacia y seguridad del medicamento, a medida que se van obteniendo de los resultados de los ensayos clínicos en marcha. Y solo cuando estos datos sean positivos se concedería la autorización completa y definitiva, mientras que, en caso contrario, habría que retirar el medicamento del mercado.
El bamlanivimab abre una nueva y esperanzadora ventana en la terapia de la covid-19, pues, al contrario que otros fármacos disponibles en el mercado para otras enfermedades y que han demostrado una cierta eficacia en esta patología (remdesivir, plitidepsina, dexametasona, hidroxicloroquina, etc.), éste es el primer medicamento desarrollado y autorizado específicamente para el tratamiento de los pacientes de covid-19.
La batalla final contra el virus ha comenzado.
Francisco López-Muñoz, Profesor Titular de Farmacología y Vicerrector de Investigación y Ciencia de la Universidad Camilo José Cela, Universidad Camilo José Cela and Jose Antonio Guerra Guirao, Profesor de Farmacología y Toxicología. Facultad de Farmacia. Universidad Complutense de Madrid., Universidad Complutense de Madrid
This article is republished from The Conversation under a Creative Commons license. Read the original article.









